三生制药公布2022年中报:疫情下归母净利持续增长,现金资金再创新高
2022-08-24
今天,中国领先的生物制药公司三生制药(01530.HK)公布了2022年中报。2022年上半年,三生制药在面对行业内外压力和国内疫情挑战的情况下,实现营业收入人民币约30.9亿元,与去年同期基本持平,归母净利润9.6亿元,同比增长6.2%;每股收益0.46港元,同比增长11.4%;经营性现金流10.7亿元,同比增长31.9%,现金资金65.1亿元再创新高。
核心产品表现稳定
上半年,三生制药核心产品(特比澳、益比奥、益赛普、赛普汀和蔓迪)合计实现销售收入27.8亿元。
特比澳实现销售收入15.8亿元,同比增长3.5%,以销售额计市占率达66%,继续位居血小板药物市场首位。
上半年,特比澳准入医院数量突破4000家,其肿瘤领域的应用由化疗所致血小板减少症(CIT)扩展至肿瘤治疗所致血小板减少症(CTIT),进一步拓宽患者覆盖范围。5月,特比澳治疗儿童或青少年的慢性原发性免疫性血小板减少症(儿童ITP)的III期临床试验达到预设的主要终点,已准备向CDE递交NDA申请;此外,特比澳在慢性肝病导致的血小板减少症患者中开展的II期临床试验已完成,预计2025年上市。
益比奥和赛博尔合计实现销售收入5.3亿元,同比持平,市场份额较去年年末进一步提升至44.1%,继续在国内促红素市场保持领先。未来,公司促红素还将在三个领域具备增量空间:肾科方面,我国终末期慢性肾病患者有350万人,透析患者80余万人,而贫血治疗率不足四成,随着肾性贫血治疗的血红蛋白标准提升,用药需求将进一步增加;非肾方面,我国有400余万肿瘤化疗患者,贫血治疗率极低,仅为10%左右,2019年化疗诱导性贫血(CIA)适应症纳入医保,科室覆盖不断增加,同时,《肿瘤相关性贫血实践指南2022》中增加36000IU治疗骨髓异常增生综合征(MDS)的I级推荐,有助于产品提升非肾领域渗透率;此外,基药目录的实施推动基层医疗机构足量用药意愿提升,益比奥、赛博尔满足基药覆盖的全部3个规格。
益赛普实现销售收入2.3亿元。作为中国内地市场推出的首个TNF-α抑制剂产品,益赛普上半年以患者为中心,推动营销流程优化,强化新患获取和患者管理;拓展新剂型,注射套装于3月上市,预充针剂型预计年底上市;开拓新合作,与中医风湿体系合作,在其他生物制剂未进入前成为中医药物联合治疗首选;持续基层下沉,积极推动基药目录准入工作,大力推进强直乡村振兴项目,提高基层诊疗水平,巩固先入优势。
赛普汀实现销售收入约6800万元,同比大增112%。作为国内863计划、国家重大新药创制项目,优先审评品种,赛普汀于2020年获批上市并在当年即纳入医保目录,打破进口产品在抗HER2单抗市场的垄断局面。其更强的ADCC效应,更低的免疫原性风险让临床医生对于它的认可持续提升,在今年上半年,CSCO(中国临床肿瘤学会)发布的《乳腺癌诊疗指南(2022年)》中,赛普汀(伊尼妥单抗)被纳入HER2阳性晚期乳腺癌的一线治疗,这一调整打开了赛普汀的增长瓶颈,显著拓宽了覆盖患者规模;覆盖终端医疗机构从百家左右上升至超过1000家;覆盖患者数量显著增长,月均用药患者数同比提升数倍;人均用药时长DOT也显著延长。
毛发健康业务快速增长
2022年上半年,蔓迪实现销售收入3.7亿元,同比增长42%。连续第七年保持高速增长。根据中国药学会数据,蔓迪2022年占中国内地市场米诺地尔市场份额达71.9%,较2021年底有所提升,仍然处于绝对领先的地位。
分渠道来看,上半年院线渠道受疫情影响增速稍有放缓,蔓迪销售收入同比增长7%,下半年将继续与雍禾植发等民营连锁医疗机构深入合作,继续发挥专业学术渠道作用,引导患者向电商和药店转化;药店渠道中,蔓迪销售收入同比增长超过80%,覆盖药店提升至9万家,百强连锁总部覆盖率近90%,旗下蔓生华发大药房已获得互联网药店资格;电商渠道中,蔓迪销售收入增长39%,线上年触达人群超过2000万人,客户超过200万人,客户转化率、女性用户占比持续上升,显示出优异的运营效果。
CDMO业务持续发力
上半年,公司CDMO业务实现收入约5500万元,同比增长38.1%,其中海外子公司Sirton收入同比增长32%,国内子公司服务收入同比增长67%。目前,公司共有超过20个正在执行的CDMO项目,上半年疫情封控期间,位于上海张江基地的晟国医药作为CDMO的核心业部分,62位员工超过75天驻厂生产,实现了100%的客户项目达成率,在行业取得了优异的口碑。目前集团CDMO业务在手订单金额过亿元,较去年同期大幅增长,并有1款抗体药物产品已经进行到NDA上市申请阶段并获得受理,超越绝大多数同行,体现了三生CDMO业务对新药研发的全流程服务能力。
三生制药是国内最早从事生物药研发和生产的药企之一,具有丰富的生物药研发和生产经验,在CDMO领域,尤其是后端商业化领域竞争优势明显。自成立独立平台以来,集团CDMO业务的建设覆盖从细胞株开发、到注册、临床、生产的全流程,国内外6大基地联动,不但能够提供柔性化生产体积,还实现了对抗体、蛋白、多肽和核酸药物以及细胞治疗等生物药物的全面布局。团队拥有超过50项内外部IND项目经验,从DNA到IND的平均用时仅15个月,IND申报失败率为0,可确保24小时极速响应,客户需求在1天内做出反馈。这些都是CDMO业务持续增长的动力来源。
目前,公司CDMO业务由北方药谷德生(沈阳)生物科技有限责任公司(德生生物)、上海晟国医药发展有限公司(晟国医药),广东三生制药有限公司(广东三生)和意大利Sirton制药等子公司共同构成,拥有沈阳(2个)、上海、广东、苏州、和意大利6大生产基地。其中,德生生物首期7.6万升产能预计将于2022年开始投产,苏州基地二期工程已于8月开工,预计2025年完工投产。
新药研发取得重要进展
上半年,三生制药研发取得多项重要进展,研发费用共计2.9亿元。截至6月30日,研发管线中包括33项在研产品,其中26项作为国家创新药物开发,肿瘤产品11项,自免产品13项,肾科产品9项,皮肤科产品1项。
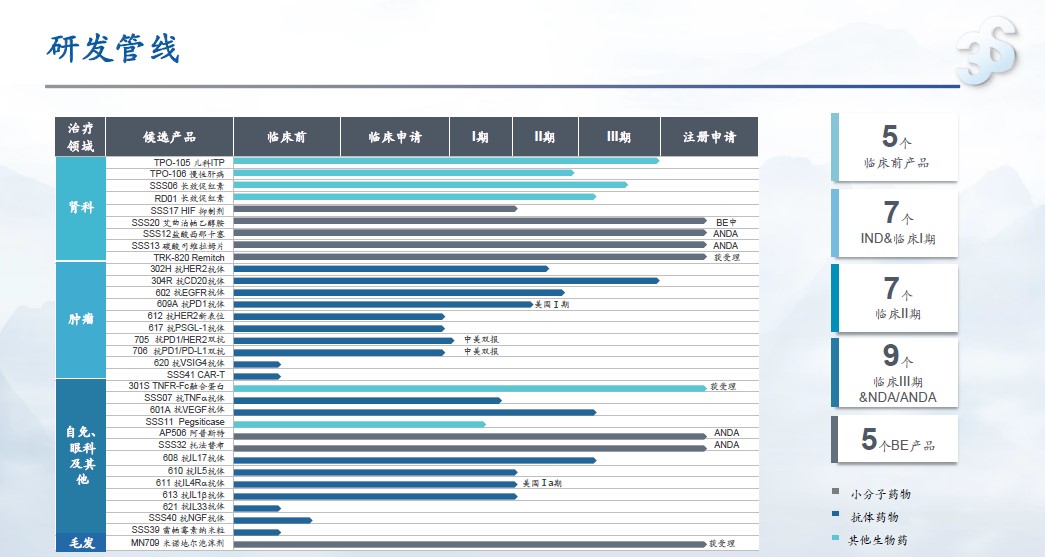
截至2022H1三生制药在研管线
上半年重点项目进展包括:
肾科领域:
l TPO-105 (儿科ITP)Ⅲ期临床已完成,正准备提交NDA申报
l TPO-106 (慢性肝病)完成Ⅰb/Ⅱ期临床,准备申请III期
l SSS06 长效EPO(双周制剂)肾性贫血 Ⅲ期临床中,准备肿瘤相关贫血的IND申请
l RD01 长效EPO(月制剂) CKD III期方案筹备中,准备提交骨科围手术期贫血的IND申请
l SSS17 HIF抑制剂 Ib结束,准备II期临床启动
l Remitch(盐酸纳呋拉啡口崩片 )完成并通过CDE现场核查,准备提交肝病适应症IND申请
自免领域:
l 301S TNFα -Fc融合蛋白上市申请CDE已受理
l 601A 抗VEGF抗体 III期临床获CDE批准
l 608 抗IL-17抗体(PsO)II期临床达到预设终点,III期方案准备中
l 610抗IL-5抗体 II期入组中,将启动临床II/III期联合设计的研究
l 611 抗IL-4R抗体 AD国内Ib临床入组完成,慢性鼻窦炎伴鼻息肉患者的II/III期适应性设计研究的IND申请
l 613 抗IL-1β抗体完成在急性痛风性关节炎患者Ib/II期研究的首例入组
毛发领域:
l MN709 (米诺地尔泡沫剂) 上市申请CDE已受理,等待现场检查
肿瘤领域:
l 617(抗PSGL-1单克隆抗体)取得IND批件
l 705 (PD1/HER2双抗)完成临床I期首例患者入组
l 706 ( PD1/PDL1双抗)完成临床I期启动前准备工作
公司自主研发的抗IL-17A单抗608用于治疗中重度斑块状银屑病患者的II期临床试验于近日达到主要终点,并显示出潜在同类更优的疗效。从疗效上看,在12周诱导治疗期,608三个剂量组分别可使80.6%、89.3%、91.4%的受试者同时实现PASI 90(皮损面积减少90%)和sPGA 0/1(医生判定的症状完全清除),而约半数患者会在短短12周内实现皮损完全清除(PASI 100),而安慰剂组则无应答(0)。从生产上看,608有着更高的细胞表达量,意味着商业化上更低的生产成本,有望为国内百万银屑病患者提供更有效,更具性价比的,更加触手可及的国产药物。
上半年,三生制药完成两项重要的license-out合作。1月,公司将抗PD-1单抗609A用于肿瘤免疫联合疗法syncrovax™的全球权益授权给美国Syncromune公司,目前公司已收到首付款,并将有望收取里程碑付款及其他激励。6月,公司将赛普汀(伊尼妥单抗)抗体序列用于抗体偶联药物(ADC)开发和商业化的全球权益授权给成都科岭源,有望获得包括首付款、研发里程碑付款及销售里程碑付款在内合计10.25亿人民币的对价,以及未来产品上市后的销售分成。
此外,公司License-in项目也在持续推进。与美国Verseau公司合作的靶向PSGL-1单克隆抗体(617)中国IND已于3月获批,计划下半年完成临床I期启动前准备工作;选取瑞士Numab公司一款三特异性抗体(715,MSLN-CD3-HAS)作为首个授权产品,715是全球在研的第二个靶向MSLN的三特异性T细胞衔接抗体,也是唯一一个MSLN双价结合的三特异性T细胞衔接抗体。
在毛发领域,7月份我们与欧洲制药公司Cosmo合作,获得AR拮抗剂克拉考特酮痤疮适应症在大中华商业化权益和脱发适应症的优先购买权。克拉考特酮是美国食品和药物管理局近40年来批准的首款具有全新作用机制的痤疮药物,是美国处方最多的外用痤疮药物品牌。三生与Cosmo在克拉考特酮上的合作可能为国内数以亿计的痤疮和脱发患者治疗带来新的选择,将在中国市场展现出极大的市场潜力。
三生制药董事长娄竞博士表示:“2022年上半年,随着国内疫情的反复,疫情防控和隔离管控政策对医药行业研发,生产和销售工作都产生了一定程度的影响。集团及时采取一系列的保障措施,最大程度保障了集团产品的研发、生产,以及CDMO客户项目的进展和交付,减轻疫情对生产经营的冲击。展望2022年下半年,我们认为自主创新仍将是医药行业的主旋律。下半年集团将加快推进各业务条线的进展,聚焦生物医药创新成果的落地,同时不断巩固毛发领域的龙头实力,坚持CDMO服务的布局与积累,力争实现业绩的持续增长和股东的持续回报。”
关于三生制药
三生制药是一家集研发、生产和销售为一体的生物制药领军企业,致力于以高品质的药品提高患者生存质量,为人类健康造福。目前,公司拥有100余项国家发明专利授权,30余种上市产品,覆盖肾科、肿瘤科、自身免疫性疾病、眼科及皮肤科等多种治疗领域。公司拥有抗体药物国家工程研究中心以及生物药和化药双平台的4大研发中心,共有33种在研产品,其中26种为国家新药,并拥有符合GMP标准的5大生产基地。未来,三生制药将继续秉持“珍爱生命、关注生存、创造生活”的理念,全力打造全球领先的中国生物制药企业。请访问www.3sbio.com获取更多信息。
警示说明及前瞻性陈述
本新闻稿包含前瞻性陈述,例如涉及业务和产品前景,或公司的意图、计划、认知、预期及策略。该等前瞻性陈述是根据本公司现有的资料,并按本新闻稿发布时的展望陈述。该等前瞻性陈述基于若干预测、假设及前提,其中一些是主观性的或不受我们控制。该等前瞻性陈述可能被证明是不正确的,或将来可能无法实现。就任何新产品或产品的新适应症, 我们无法确保其将能成功开发或最终上市销售。该等前瞻性陈述受各种风险及不明朗因素影响。我们的其他公开披露文件可能提供该等风险及不明朗因素的更多信息。所涉及之科学信息可能只是初步的和研究性的。本公司股东及潜在投资者在买卖本公司股份时,请务必谨慎行事。